Электролиз — понятие, правила применения и схемы процесса
Понятие электролиза
Электролиз — процесс, который возникает при воздействии электрического тока на электролит и заключается в выделении электродами составных частей.

Значение явления заключается в том, что путём воздействия электричества на ионы можно организовывать новые формы, структуры или даже сами вещества. Это позволяет человеку контролировать некоторые процессы, протекающие на молекулярном уровне. Законы данного явления в химии и физике открыл английский учёный Фарадей.
Явление происходит при участии электродов, которые делятся на катод и анод:
— электрод с отрицательным зарядом, на котором происходит восстановление катионов;
— электрод с положительным зарядом, где происходит окисление анионов.
Приборы чаще всего изготавливаются из материалов, пропускающих электрический ток, например, из графита или большинства металлов. Оба прибора подключаются к отрицательному и положительному полюсам соответственно.
Явление происходит в следующем порядке:
- Диссоциация.
- Электролиз.
Очень важно не путать такие близкие определения, как гидролиз и электролиз. Первым явлением считается разложение раствора вещества на ионы (заряженные частицы) в воде.
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например: Zn2+ +2e → Zn0.
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2: 2H2O + 2e → H20 + 2OH–. Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества: 2H+ +2e → H2. Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F–), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ: 2Cl– – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H+ написать не можем, так как OH– и H+ не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H+ +2e → H2), а на аноде протекают только процессы окисления. 4OH– – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению: 2H2O – 4e → O2 + 4H+. Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи: 2R-COO– – 2e → R-R + 2CO2.



Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.

Правило подкреплено формулой m = k * q
, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
- нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
- если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
- при этом будет верным следующее равенство: Г= Г1+Г2.
Второй закон Фарадея
Данное правило, установленное Фарадеем, указывает на зависимость между атомной массой вещества, количеством возможных химических связей и самим электрохимическим эквивалентом.

Таким образом, электрохимический эквивалент прямо пропорционален атомной массе вещества, но валентности вещества он обратно пропорционален.
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность.
Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы. Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду.

Что такое электролиз.
У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху. Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).
Будет интересно➡ Постоянный ток — определение и параметры
Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.
Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора. Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).

Электролиз медного купороса.
Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе.
С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.

Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
Масса вещества mэ, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ: mэ = α/τ,здесь а – электрохимический эквивалент вещества, г/Кл.
Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n: mэ = А / 96480n, здесь 96480 – число Фарадея, Кл х моль-1.
Интересно почитать: то такое датчик Холла.
Таким образом, электрохимический эквивалент вещества α= А / 96480n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества – кулоном (ампер-секундой). Для меди А = 63,54, n =2, α =63,54/96480-2= 0,000329 г/Кл, для никеля α =0,000304 г/Кл, для цинка α=0,00034 г/Кл. В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами.

Химические реакции при электролизе.
Таблица изменения веществ с помощью электролиза
Усиление восстановительных способностей веществ:
| Na+ | Mg2+ | Al3+ | Zn2+ | Fe3+ | Ni2+ | Sn2+ | Pb2+ | H+ | Cu2 | Ag+ |
| Натрий | Магний | Алюминий | Цинк | Железо | Никель | Олово | Свинец | Водород | Медь | Серебро |
Усиление окислительных способностей веществ:
| I- | Br- | Cl- | OH- | NO3- | CO32- | SO42-. |
| Йодид (соли, образованные йодоводородной кислотой) | Бромид (соли, образованные бромоводородной кислотой) | Хлорид (соли, образованные соляной кислотой) | Гидроксид | Нитрат (соли, образованные азотной кислотой) | Карбонат (соли, образованные угольной кислотой) | Сульфат (соли, образованные серной кислотой) |
| Катод (отрицательный) | Анод (положительный) |
| Восстановление катионов после водорода | Окисление анионов кислот, не содержащих кислорода |
| Восстановление катионов, имеющих среднюю активность | Окисление анионов оксокислот |
| Восстановление наиболее активных катионов | Окисление анионов гидроксидов |
| Восстановление катионов водорода |
Уравнения и схемы процессов электролиза, протекающих на катоде и аноде
Электролиз воды
Вода является слабым электролитом, из-за чего процесс будет протекать очень медленно.
Общее уравнение реакции: 2H2O => 2H2
+ O2.

Схема водного электролиза:
| Анод | Катод |
| 2H2O => O2 + 4H+ + 4e– | 4H+ + 4e– => 2H2 |
| 3H2O => O3 + 6e– + 6H+ | O2 + 2H2O + 2e– => H2O2 + 2OH– |
Электролиз расплавов солей
Данную разновидность реакции можно рассмотреть на примере расплава гидроксида натрия, то есть NaOH.

Na+ + 1ē => Na0 (восстановление)
Особенности электролиза расплавов
В расплаве электролит непосредственно подвергается воздействию электрического тока. Металл всегда образуется на катоде, а продукт анода зависит от природы вещества.
При разложении расплава оснований на катоде образуется металл, а на аноде окисляется кислород. (расплав соли – это чистое вещество без примесей в основном твердые вещества)
Разложение расплавов солей происходит по-разному у бескислородных и кислородосодержащих. У бескислородной соли на аноде окисляется анион – кислотный остаток, а у кислородосодержащей – окисляется кислород.
Рассмотрим пример электролиза расплава бескислородной соли – хлорида калия. Под действием постоянного электрического тока соль разлагается на катионы калия и анионы хлора.
- KCl → K+ + Cl-
Катионы K+ перемещаются к катоду и принимают электроны, происходит восстановление металлического калия.
- Катодный процесс: K+ + e- → K0
Анионы Cl- движутся к аноду, отдавая электроны, происходит образование газообразного хлора.
- Анодный процесс: 2Cl- — 2e- → Cl20↑
Суммарное уравнение процесса электролиза расплава хлористого калия можно представить следующим образом:
- 2KCl (эл.ток) 2K0 + Cl20↑
Электролиз расплавов и растворов (солей, щелочей, кислот)
Содержание:
Сильнейшим окислительно – восстановительным действием обладает электрический ток. С помощью воздействия электрического тока на вещество можно получить чистый металл. Этот метод называется электролизом.
Электролиз – процесс, при котором происходит разложение вещества электрическим током.
Процесс электролиза может протекать только в веществах, проводящих электрический ток, то есть электролитах. К электролитам относят представителей основных классов неорганических соединений – кислоты, соли, щелочи.
Для протекания процесса требуется устройство, называемое электролизером.

Данное устройство работает от внешнего источника питания, который подает электрический ток. Представляет собой емкость, в которую опущены два электрода (катод и анод), заполнена емкость электролитом. При подаче электрического тока происходит разложение вещества. Для того чтобы узнать протекает электролиз или нет, в цепь включают лампочку, если лампочка загорается, значит в системе есть ток, если при замыкании цепи, лампочка не горит, то электролиз не протекает – вещество является не электролитом.
Катод (-) – является отрицательно заряженным электродом, катионы ( + ) перемещаются к нему и происходит процесс восстановления.
Анод (+) – положительно заряженный электрод, к нему перемещаются анионы (-) и происходит процесс окисления.
Можно выделить два типа электролиза для расплавов и растворов. Ход этих двух процессов происходит по-разному. Зависит по большей части это от содержания воды в растворе, которая тоже принимает участие в процессе. В расплаве происходит разложение только вещества.
Особенности электролиза расплавов
В расплаве электролит непосредственно подвергается воздействию электрического тока. Металл всегда образуется на катоде, а продукт анода зависит от природы вещества.
При разложении расплава оснований на катоде образуется металл, а на аноде окисляется кислород. (расплав соли – это чистое вещество без примесей в основном твердые вещества)

Разложение расплавов солей происходит по-разному у бескислородных и кислородосодержащих. У бескислородной соли на аноде окисляется анион – кислотный остаток, а у кислородосодержащей – окисляется кислород.

Рассмотрим пример электролиза расплава бескислородной соли – хлорида калия. Под действием постоянного электрического тока соль разлагается на катионы калия и анионы хлора.
Катионы K + перемещаются к катоду и принимают электроны, происходит восстановление металлического калия.
- Катодный процесс: K + + e – → K 0
Анионы Cl – движутся к аноду, отдавая электроны, происходит образование газообразного хлора.
- Анодный процесс: 2Cl – — 2e – → Cl2 0 ↑
Суммарное уравнение процесса электролиза расплава хлористого калия можно представить следующим образом:
Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.

2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Me n+ + ne
б) На не растворимом аноде (графит, платина) обычно окисляются анионы S – , J – , Br – , Cl – , OH – и молекулы H2O:
- 2J – => J2 0 + 2e;
- 4OH – => O2 + 2H2O + 4e;
- 2H2O => O2 + 4H + + 4e
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
В результате можно создать общее уравнение электролиза:
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na + + Cl –
- Катод: Cu 2+ + 2e – → Cu 0
- Анод: Cu 0 — 2e – → Cu 2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
Молекулы воды окисляются на аноде и выделяется кислород.
В результате получаем общее уравнение электролиза:
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
На аноде откладываются молекулы кислорода.
Получаем суммарное уравнение электролиза:
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
Применение электролиза
Процессы электролиза нашли свое применение в промышленности в первую очередь для получения чистых металлов электрохимическим путем. Побочными продуктами этого процесса являются кислород и водород, поэтому он является промышленным способом получения этих газов. Очень часто применяют для очистки металлов от примесей и защиты от коррозии.
Парообразование, испарение и кипение — свойства, условия и примеры
Агрегатное состояние воды может быть твёрдым, жидким, газообразным. Речь пойдёт о двух последних фазах, наблюдаемых при парообразовании: испарении, кипении. Двигателем фазовых переходов влаги является изменение температуры, в рассматриваемом случае — повышение градусов при нагревании. Не менее важно и влияние других внешних факторов. Обратный парообразованию процесс называется конденсация, он завершает цикл круговорота воды в природе.

Виды изменений жидкости при нагревании
Фазовый переход — превращение вещества из одного агрегатного состояния в другое. Понятие это более общее, чем положение о твёрдой, жидкой и газообразной формах. Различные фазы могут находиться в пределах одного физического положения воды и называются сообразно физике процесса. Определения переходов жидкости под влиянием температуры:

Переход вещества из газообразной формы в жидкость — обратное превращению воды в пар действие, называется конденсацией. При этом всегда выделяется энергия, почему и требуется отводить теплоту от вещества для поддержания процесса. Температура перехода совпадает с точкой кипения.
Процессы парообразования и испарения
Причиной распада жидкости с выветриванием из вещества лёгких фракций считается разница температур на границе фазного перехода: воздух обычно теплее жидкости, что и вызывает испарение. Процесс протекает медленно, когда ему не способствуют внешние факторы, отличается от кипения тем, что отделение пара происходит только с водной поверхности.
Если естественное парообразование с зеркальной глади озера может быть незаметным, то процесс перехода в пар кипением всегда является интенсивным. Наглядный пример бурного природного парообразования — гейзер, выбрасывающий из недр под давлением горячую воду с паром. На способность жидкости испаряться быстрее или медленнее влияют несколько факторов:

Для определения количества теплоты, необходимого для превращения 1 кг жидкости в пар, используется физическая величина, обозначаемая в физике буквой L. У воды при температуре 0ºС этот показатель равен 2500 кДж/кг, а в стадии кипения удельная теплота парообразования меньше — 2260. Для сравнения: у этилового спирта L =906, у эфира — 356 кДж на кг. Величина L =0 у воды при 374,15ºС.
Рассчитать кипящую жидкость на нужное для перехода в пар количество теплоты можно по формуле Q = L *m.
Образование конденсата как завершение цикла
Одновременно с испарением при температуре кипения вещества происходит его превращение в жидкость. Хаотичное движение молекул над поверхностью воды или другого текучего субстрата приводит к их столкновению, а при совпадении векторов скорости в направлении к жидкости происходит возврат капель в кипящую среду. Конденсация длится на протяжении всего времени кипения, то есть пока температура остаётся равной 100ºС, если это вода. Другая часть испарившихся молекул улетучивается в атмосферу. В разных обстоятельствах взаимодействие парообразования и конденсации отличается:

Парообразование, составляющими которого являются испарение и кипение, всегда завершается конденсацией. В природе благодаря этим процессам непрерывно осуществляется водообмен между морями, реками, сушей, атмосферой.
Круговорот воды обеспечивает окружающий человека мир и его самого полезными веществами, способствует сохранению естественной среды обитания живых организмов.
Насыщенный и ненасыщенный пар

О чем эта статья:
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. ? Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
из глубины жидкости к поверхности, а затем в воздух;
только из жидкости к поверхности;
к поверхности из воды и газовой среды одновременно;
к площади поверхности только от воздуха.
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
при любой температуре
с поверхности жидкости
при определенной температуре
с поверхности жидкости
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный.
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.
Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м 2 × кг × с -2 × К -1 × моль -1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.
В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.
Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K
Парообразование и конденсация в физике – основные понятия, формулы и определение с примерами
Содержание:
- Каковы особенности испарения жидкости
- Какой пар называют насыщенным
- От каких факторов зависит давление насыщенного пара
- Как и почему кипит жидкость
- От каких факторов зависит температура кипения жидкости
- Какой пар называют насыщенным
Парообразование и конденсация:
Любое вещество при определенных условиях может переходить из одного фазового (агрегатного) состояния в другое. Влажная одежда может «замерзнуть», а может высохнуть, водяной пар может собраться в капельки воды, образуя туман или росу, а может превратиться в иней. Вспомним, при каких условиях происходит переход вещества из жидкого состояния в газообразное и наоборот.

Каковы особенности испарения жидкости
Процесс перехода вещества из жидкого состояния в газообразное называют парообразованием.
Есть два способа перехода жидкости в газ: испарение и кипение.
Испарение — это процесс парообразования с поверхности жидкости.
С точки зрения МКТ парообразование — это такой процесс, когда с поверхности жидкости вылетают быстрые молекулы. Действительно, молекулы жидкости непрерывно движутся (колеблются около положений равновесия, время от времени перепрыгивают с места на место), но силы притяжения не дают им разлететься. Однако в жидкости всегда есть молекулы, кинетическая энергия которых в несколько раз превышает ее среднее значение. Когда эти «быстрые» молекулы оказываются на поверхности жидкости, их энергии хватает для того, чтобы, преодолев притяжение соседних молекул, покинуть жидкость.
Зная механизм испарения, отметим некоторые его особенности.
- Испарение происходит при любой температуре. Чем выше температура жидкости, тем больше в ней «быстрых» молекул, поэтому с увеличением температуры скорость испарения увеличивается. Поскольку жидкость покидают молекулы, кинетическая энергия которых выше средней, то средняя кинетическая энергия оставшихся молекул уменьшается, то есть при отсутствии теплообмена процесс испарения вызывает охлаждение жидкости.
- Испарение сопровождается поглощением энергии: энергия расходуется на совершение работы против сил межмолекулярного притяжения и сил внешнего давления. Чем меньше давление на свободную поверхность жидкости, тем быстрее жидкость испаряется.
- Скорость испарения увеличивается при увеличении площади свободной поверхности жидкости (на поверхности жидкости будет больше молекул с достаточной кинетической энергией).
- Разные жидкости испаряются с разной скоростью (спирт испаряется почти мгновенно, вода — медленнее, а капля ртути будет испаряться годами, отравляя воздух). Очевидно, что медленнее испаряются те жидкости, молекулы которых сильнее взаимодействуют друг с другом.
Какой пар называют насыщенным
Скорость испарения зависит от движения воздуха: волосы быстрее высохнут, если их сушить феном; лужи после дождя быстрее исчезнут в ветреную погоду. Такую зависимость легко объяснить с точки зрения теплового движения молекул. Около поверхности жидкости всегда существует «облако» покинувших ее молекул, то есть пар этой жидкости. Молекулы пара беспорядочно движутся, сталкиваясь друг с другом и с молекулами других газов. Благодаря диффузии и движению воздуха некоторые молекулы пара удаляются от поверхности жидкости и уже никогда в нее не возвращаются. Другие молекулы, наоборот, могут оказаться так близко к поверхности, что силы межмолекулярного взаимодействия «захватывают» их и возвращают в жидкость (см. рис. 31.2). Если бы молекулы, покинувшие жидкость, не возвращались, то скорость испарения была бы огромной. Например, при комнатной температуре ведро воды испарилось бы менее чем за час.
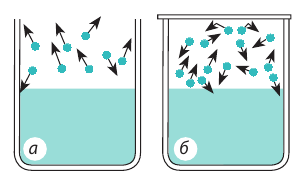
Рис. 31.2. Молекулы, покинувшие жидкость, могут снова вернуться в нее вследствие теплового движения: а — пар над поверхностью жидкости ненасыщенный; б — пар над поверхностью жидкости насыщенный
Таким образом, наряду с процессом испарения, в ходе которого жидкость переходит в пар, существует обратный процесс, в ходе которого вещество из газообразного состояния переходит в жидкое.
Процесс перехода вещества из газообразного состояния в жидкое называют конденсацией.
Испарение сопровождается поглощением энергии; при конденсации энергия выделяется. Закроем крышкой сосуд с некоторым объемом жидкости (рис. 31.2, б). Поверхность жидкости по-прежнему будут покидать «быстрые» молекулы, масса жидкости будет уменьшаться, а концентрация молекул пара — увеличиваться. Одновременно часть молекул будет возвращаться из пара в жидкость. Очень быстро концентрация молекул пара над жидкостью станет настолько высокой, что число молекул, возвращающихся в жидкость, будет равно числу молекул, покидающих ее за то же время, — между процессами конденсации и испарения установится динамическое равновесие.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называют насыщенным паром.
Обратите внимание! Концентрация молекул насыщенного пара — наибольшая возможная концентрация молекул пара при данной температуре; пар, концентрация молекул которого меньше, чем в насыщенном, называют ненасыщенным паром.
От каких факторов зависит давление насыщенного пара
Для насыщенного пара, как и для любого газа, справедливо равенство p=nkT. То есть при данной температуре T давление p насыщенного пара прямо пропорционально концентрации n его молекул.
Поскольку концентрация молекул насыщенного пара зависит от рода жидкости, то и давление насыщенного пара зависит от рода жидкости (табл. 1).
Давление насыщенного пара при 20 °C
| Вещество | Давление, мм рт. ст. |
|---|---|
| Ртуть | 0,0013 |
| Вода | 17,36 |
| Хлороформ | 160,5 |
| Эфир | 442,4 |
| Хлор | 5798 (7,63 атм) |
| Аммиак | 6384 (8,4 атм) |
Чем больше силы межмолекулярного взаимодействия, тем меньше концентрация молекул насыщенного пара и, следовательно, тем меньше его давление. Кроме того, давление насыщенного пара зависит от температуры. При увеличении температуры давление насыщенного пара растет гораздо быстрее, чем давление идеального газа (рис. 31.3).
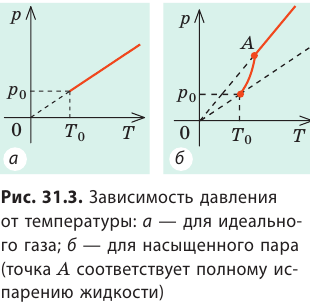
Дело в том, что одновременно с ростом температуры увеличивается концентрация молекул пара.
Обратите внимание! Если повышение температуры приведет к полному испарению жидкости, то в дальнейшем пар станет ненасыщенным и его давление будет линейно зависеть от температуры.
Давление, создаваемое насыщенным паром, — наибольшее давление, которое может создать пар данной жидкости при данной температуре. Если уменьшить объем, занимаемый насыщенным паром, то на короткое время концентрация молекул пара увеличится, динамическое равновесие нарушится и число молекул, поступающих в жидкость, превысит число молекул, покидающих ее.
Конденсация будет преобладать над испарением до тех пор, пока концентрация молекул пара не уменьшится до концентрации молекул насыщенного пара, а давление не станет равным давлению насыщенного пара. С увеличением объема, занимаемого насыщенным паром, наоборот, будет преобладать процесс испарения, и в результате снова установится начальное давление. Таким образом, в отличие от идеального газа, давление насыщенного пара не зависит от его объема (рис. 31.4).
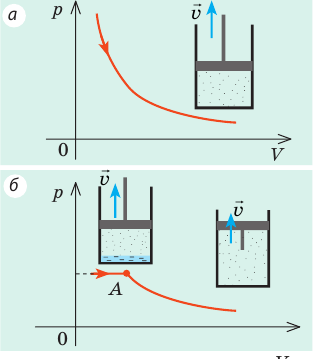
Рис. 31.4. Зависимость давления от объема: а — для идеального газа; б — для насыщенного пара. Точка А соответствует полному испарению жидкости; пар становится ненасыщенным, и его давление уменьшается обратно пропорционально объему
Как и почему кипит жидкость
Если к сосуду с жидкостью подвести достаточное количество теплоты, температура жидкости будет увеличиваться, а дно и стенки сосуда покроются пузырьками. Эти пузырьки содержат воздух и насыщенный пар, давление которых будет расти с ростом температуры. Как только давление газа внутри пузырьков превысит внешнее давление, пузырьки начнут увеличиваться в объеме (рис. 31.5, а).
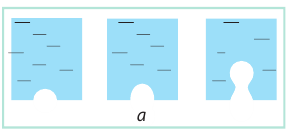
Рис. 31.5. Механизм кипения жидкости
Наконец под действием архимедовой выталкивающей силы они оторвутся от дна сосуда и начнут всплывать; на месте оторвавшихся пузырьков останется небольшое количество газа — «зародыши» новых пузырьков (рис. 31.5, б).
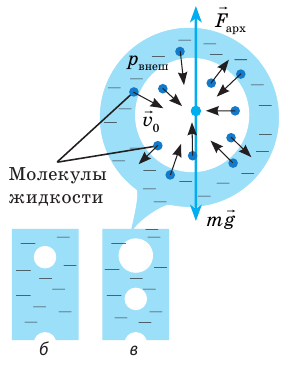
Рис. 31.5. Механизм кипения жидкости
Пока верхние слои жидкости чуть холоднее нижних, в верхних слоях часть водяного пара в пузырьках конденсируется и они «схлопываются». Этот процесс сопровождается шумом и образованием многочисленных мелких пузырьков газа — жидкость «кипит белым ключом». Когда жидкость полностью прогреется, пузырьки, поднимаясь, увеличиваются в объеме, ведь в их середину непрерывно испаряется жидкость (рис. 31.5, в). Достигнув поверхности жидкости, пузырьки лопаются, выбрасывая пар в атмосферу; жидкость при этом бурлит и клокочет — кипит (рис. 31.5, г).
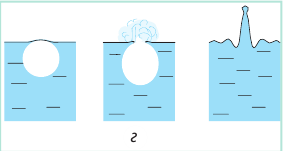
Рис. 31.5. Механизм кипения жидкости
Кипение — процесс парообразования, который происходит по всему объему жидкости и сопровождается образованием и ростом пузырьков пара.
От каких факторов зависит температура кипения жидкости
Продолжая нагревать уже кипящую жидкость, можно заметить, что во время кипения температура жидкости не изменяется (рис. 31.6).
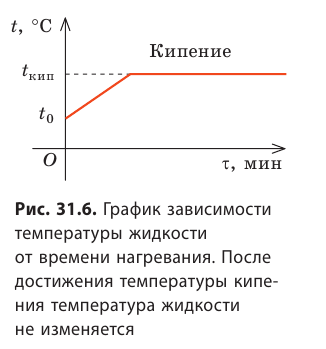
Если увеличить количество теплоты, подводимой к жидкости, то увеличится количество пузырьков, то есть возрастет интенсивность парообразования. Таким образом, при кипении вся подводимая энергия идет на парообразование.
Жидкость начинает кипеть (пузырьки начинают увеличиваться в объеме) только тогда, когда давление газа в пузырьках (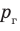 ) становится чуть больше давления в жидкости (
) становится чуть больше давления в жидкости (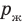 ). В пузырьках содержатся воздух и насыщенный пар, однако воздуха в них гораздо меньше, чем пара, поэтому давление газа в пузырьках примерно равно давлению насыщенного пара
). В пузырьках содержатся воздух и насыщенный пар, однако воздуха в них гораздо меньше, чем пара, поэтому давление газа в пузырьках примерно равно давлению насыщенного пара 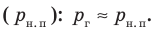 Давление в жидкости складывается из внешнего давления (давления на поверхность жидкости) (
Давление в жидкости складывается из внешнего давления (давления на поверхность жидкости) ( ) и гидростатического давления столба жидкости (ρgh ):
) и гидростатического давления столба жидкости (ρgh ): 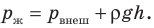 Если глубина сосуда меньше метра, то гидростатическим давлением жидкости можно пренебречь, поэтому
Если глубина сосуда меньше метра, то гидростатическим давлением жидкости можно пренебречь, поэтому 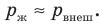
Кипение начинается при температуре, при которой давление насыщенного пара немного превышает внешнее давление.
Чем меньше внешнее давление, тем при более низкой температуре кипит данная жидкость (рис. 31.7). Если налить в колбу воду и насосом откачивать из колбы воздух, то вода закипит даже при комнатной температуре. И наоборот, если необходимо повысить температуру кипения жидкости, ее нагревают в условиях повышенного давления (рис. 31.8).
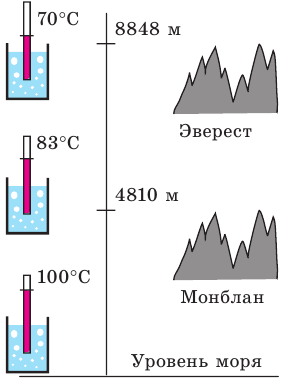
Рис. 31.7. температура кипения воды на разных высотах (и соответственно — при разном давлении)

Рис. 31.8. До высоких температур воду нагревают в автоклавах. При давлении свыше 100 атмосфер температура кипения воды увеличивается до 300 °С
Поскольку давление насыщенного пара зависит от рода жидкости, то при одинаковом внешнем давлении каждое вещество имеет свою температуру кипения (табл. 2).
Температура кипения веществ при нормальном атмосферном давлении
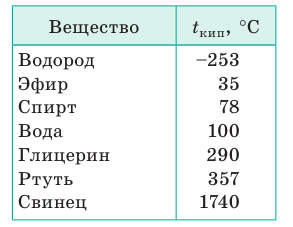
Чем меньше силы межмолекулярного притяжения в жидкости, тем ниже температура ее кипения. Температура кипения жидкости зависит от наличия в ней растворенного газа. Если долго кипятить воду и таким образом удалить из нее растворенный газ, то повторно при нормальном давлении эту воду можно будет нагреть до температуры выше 100 °С.
- Процесс перехода вещества из жидкого состояния в газообразное называют парообразованием. Парообразование может происходить двумя путями: испарением и кипением.
- Испарение — процесс парообразования с поверхности жидкости. Наряду с процессом испарения существует процесс конденсации — процесс перехода вещества из газообразного состояния в жидкое.
- Кипение — процесс парообразования, происходящий по всему объему жидкости и сопровождающийся образованием и увеличением пузырьков пара. Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках немного превышает внешнее давление.
- Если за одинаковое время число молекул, вылетевших с поверхности жидкости, равно числу молекул, вернувшихся в жидкость, то жидкость и ее пар находятся в состоянии динамического равновесия. Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называют насыщенным.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Парообразование, испарение и кипение – свойства, условия и примеры
Насыщенный пар.

Если сосуд с жидкостью плотно закрыть, то сначала количество жидкости уменьшится, а затем будет оставаться постоянным. При неиз менн ой температуре система жидкость – пар придет в состояние теплового равновесия и будет находиться в нем сколь угодно долго. Одновременно с процессом испарения происходит и конденсация, оба процесса в среднем комп енсируют друг друга. В первый момент, после того как жидкость нальют в сосуд и закроют его, жидкость будет испаряться и плотность пара над ней будет увеличиваться. Однако одновременно с этим будет расти и число молекул, возвращающихся в жидкость. Чем больше плотность пара, тем большее число его молекул возвращается в жидкость. В результате в закрытом сосуде при постоянной температуре установится динамическое (подвижное) равновесие между жидкостью и паром, т. е. число молекул, покидающих поверхность жидкости за некото р ый промежуток времени, будет равно в среднем числу молекул пара, возвратившихся за то же время в жидкост ь. Пар, нах одящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Это определение подчерки вает, что в данном объеме при данной температуре не может находиться большее количество пара.
Давление насыщенного пара .
Что будет происходить с насыщенным паром, если уменьшить занимаемый им объем? Например, если сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая температуру содержимого цилиндра постоянной. При сжатии пара равновесие начнет нарушаться. Плотность пара в первый момент немного увеличится, и из газа в жидкость начнет переходить большее число молекул, чем из жидкости в газ. Ведь число молекул, покидающих жидкость в единицу времени, зависит только от температуры, и сжатие пара это число не меняет. Процесс продолжается до тех пор, пока вновь не установится динамическое равновесие и плотность пара, а значит, и концентрация его молекул не примут прежних своих значений. Следовательно, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема. Так как давление пропорционально концентрации молекул (p=nkT), то из этого определения следует, что давление насыщенного пара не зависит от занимаемого им объема. Давление pн.п. пара, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
Зависимость давления насыщенного пара от температуры.

Состояние насыщенного пара, как показывает опыт, приближенно описывается уравнением состояния идеального газа, а его давление определяется формулой Р = nкТ С ростом температуры давление растет. Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры. Однако зависимость рн.п. от Т, найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объеме. С увеличением температуры давление реального насыщенного пара растет быстрее, чем давление идеального газа (рис. уча сток кривой 12). Почему это происходит? При нагревании жидкости в закрытом сосуде часть жидкости превращается в пар. В результате согласно формуле Р = nкТ давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. В основном увеличение давления при повышении температуры определяется именно увеличением конц ентрац ии. (Главное различие в поведении и деального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объема при постоянной температуре) меняется масса пара. Жидкость частично превращается в пар, или, напротив, пар частично конденсируе тся. С идеальным газом ничего подобного не происходит.). Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возраст ать прямо пропорционально абсолютной температуре (см. рис., участок кривой 23).
Кипение – это интенсивный переход вещества из жидкого состояния в газообразное, происходящее по всему объему жидкости (а не только с ее поверхности). (Конденсация – обратный процесс.) По мере увеличения температуры жидкости интенсивность испарения увеличивается. Наконец, жидкость начинает кипеть. При кипении по всему объему жидкости образуются быстро растущие пузырьки пара, которые всплывают на поверхность. Температура кипения жидкости остается постоянной. Это происходит потому, что вся подводимая к жидкости энергия расходуется на превращение ее в пар. При каких условиях начинается кипение?

В жидкости всегда присутствуют растворенные газы, выделяющиеся на дне и стенках сосуда, а также на взвешенных в жидкости пылинках, которые являются центрами парообразования. Пары жидкости, находящиеся внутри пузырьков, являются насыщенными. С увеличением температуры давление насыщенных паров возрастает и пузырьки увеличиваются в размерах. Под действием выталкивающей силы они всплывают вверх. Если верхние слои жидкости имеют более низкую температуру, то в этих слоях происходит конденсация пара в пузырьках. Давление стремительно падает, и пузырьки захлопываются. Захлопывание происходит настолько быстро, что стенки пузырька, сталкиваясь, производят нечто вроде взрыва. Множество таких микровзрывов создает характерный шум. Когда жидкость достаточно прогреется, пузырьки перестанут захлопываться и всплывут на поверхность. Жидкость закипит. Понаблюдайте внимательно за чайником на плите. Вы обнаружите, что перед закипанием он почти перестает шуметь. Зависимость давления насыщенного пара от температуры объясняет, почему температура кипения жидкости зависит от давления на ее поверхность. Пузырек пара может расти, когда давление насыщенного пара внутри него немного превосходит давление в жидкости, которое складывается из давления воздуха на поверхность жидкости (внешнее давление) и гидростатического давления столба жидкости . Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости. Чем больше внешнее давление, тем выше температура кипения. И наоборот, уменьшая внешнее давление, мы тем самым понижаем температуру кипения. Откачивая насосом воздух и пары воды из колбы, можно заставить воду кипеть при комнатной температуре. У каждой жидкости своя температура кипения (которая остается постоянной, пока вся жидкость не выкипит), которая зависит от давления ее насыщенного пара. Чем выше давление насыщенного пара, тем ниже температура кипения жидкости.
Влажность воздуха и ее измерение.
В окружающем нас воздухе практически всегда находится некоторое количество водяных паров. Влажность воздуха зависит от количества водяного пара, содержащегося в нем. Сырой воздух содержит больший процент молекул воды, чем сухой. Боль шое значение имеет относительная влажность воздуха, сообщения о которой каждый день звучат в сводках метеопрогноза.

Отно сительная влажность — это отношение плотности водяного пара, содержащегося в воздухе, к плотности насыщенного пара при данной температуре, выраженное в процентах (показывает, насколько водяной пар в воздухе близок к насыщению).


Сухость или влажность воздуха зависит от того, насколько близок его водяной пар к насыщению. Если влажный воздух охлаждать, то находящийся в нем пар можно довести до насыщения, и далее он будет конденсироваться. Признаком того, что пар насытился является появление первых капель сконденсировавшейся жидкости – росы. Температура, при которой пар, находящийся в воздухе, становится насыщенным, называется точкой росы. Точка росы также характеризует влажность воздуха. Примеры: выпадение росы под утро, запотевание холодного стекла, если на него подышать, образование капли воды на холодной водопроводной трубе, сырость в подвалах домов. Для измерения влажности воздуха используют измерительные приборы – гигрометры. Существуют несколько видов гигрометров, но основные: волосной и психрометрический.



Так как непосредственно измерить давление водяных паров в воздухе сложно, относительную влажность воздуха измеряют косвенным путем. Известно, что от относительной влажности воздуха зависит скорость испарения. Чем меньше влажность воздуха, тем легче влаге испаряться. В психрометре есть два термометра. Один – обычный, его называют сухим. Он измеряет температуру окружающего воздуха. Колба другого термометра обмотана тканевым фитилем и опущена в емкость с водой. Второй термометр показывает не температуру воздуха, а температуру влажного фитиля, отсюда и название увлажненный термометр. Чем меньше влажность воздуха, тем интенсивнее испаряется влага из фитиля, тем большее количество теплоты в единицу времени отводится от увлажненного термометра, тем меньше его показания, следовательно, тем больше разность показаний сухого и увлажненного термометров. Определив разность показаний сухого и увлажненного термометров, по специальной таблице, расположенной на психрометре, находят значение относительной влажности.
Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
У всех веществ есть три агрегатных состояния – твердое, жидкое и газообразное, которые проявляются при особых условиях.
Фазовый переход – это переход вещества от одного состояния к другому.
Примерами такого процесса являются конденсация и испарение.
Если создать определенные условия, можно превратить любой реальный газ (например, азот, водород, кислород) в жидкость. Для этого необходимо понижение температуры ниже некоторого минимума, называемого критической температурой. Она обозначается T к р . Так, для азота значение этого параметра равно 126 К , для воды – 647 , 3 К , для кислорода – 154 , 3 К . При поддержании комнатной температуры вода может сохранять как газообразное, так и жидкое состояние, а азот и кислород – только газообразное.
Испарение – это фазовый переход вещества в газообразное состояние из жидкого.
Молекулярно-кинетическая теория объясняет этот процесс постепенным перемещением с поверхности жидкости тех молекул, чья кинетическая энергия больше, чем энергия их связи с остальными молекулами жидкого вещества. Вследствие испарения средняя кинетическая энергия оставшихся молекул уменьшается, что, в свою очередь, приводит к снижению температуры жидкости, если к ней не подведен дополнительный источник внешней энергии.
Конденсация – это фазовый переход вещества из газообразного состояния в жидкое (процесс, обратный испарению).
Во время конденсации молекулы пара возвращаются обратно в жидкое состояние.
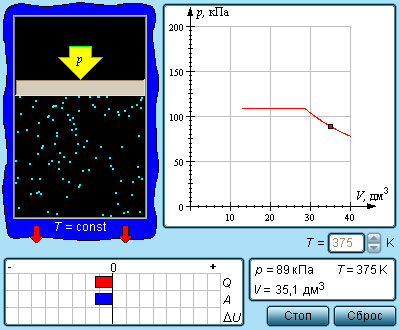
Рисунок 3 . 4 . 1 . Модель испарения и конденсации.
Динамическое равновесие
Если сосуд, в котором находится жидкость или газ, закупорен, то в таком случае его содержимое может находиться в динамическом равновесии, т.е. скорость процессов конденсации и испарения будет одинаковой (из жидкости будет испаряться столько молекул, сколько возвращается обратно из пара). Такая система получила название двухфазной.
Насыщенный пар – это пар, который находится со своей жидкостью в состоянии динамического равновесия.
Существует зависимость между количеством молекул, испаряющихся с поверхности жидкости в течение одной секунды, и температурой этой жидкости. Скорость процесса конденсации зависит от концентрации молекул пара и скорости их теплового движения, которая, в свою очередь, также находится в прямой зависимости от температуры. Следовательно, можно сделать вывод, что при равновесии жидкости и ее пара концентрация молекул будет определяться равновесной температурой. При повышении температуры необходима высокая концентрация молекул пара, чтобы испарение и конденсация стали одинаковыми по скорости.
Поскольку, как мы уже выяснили, концентрация и температура будут определять давление пара (газа), мы можем сформулировать следующее утверждение:
Давление насыщенного пара p 0 определенного вещества не зависит от объема, но находится в прямой зависимости от температуры.
Именно по этой причине изотермы реальных газов на плоскости включают в себя горизонтальные фрагменты, которые соответствуют двухфазной системе.
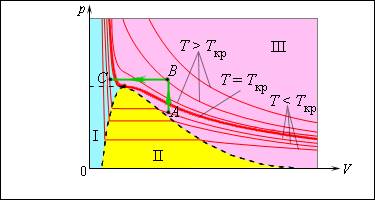
Рисунок 3 . 4 . 2 . Изотермы реального газа. Область I – жидкость, область I I – двухфазная система «жидкость + насыщенный пар», область I I I – газообразное вещество. K – критическая точка.
Если температура будет расти, увеличатся и давление насыщенного пара, и его плотность, а вот плотность жидкости, наоборот, будет снижаться из-за теплового расширения. При достижении критической для данного вещества температуры плотность жидкости и газа уравниваются, после прохождения этой точки физические различия между насыщенным паром и жидкостью исчезают.
Возьмем насыщенный пар и будем сжимать его изотермически при T T к р . Его давление будет постепенно возрастать, пока не сравняется с давлением насыщенного пара. Постепенно на дне сосуда появится жидкость, и между ней и ее насыщенным паром возникнет динамическое равновесие. По мере уменьшения объема будет происходить конденсация все большей части пара при неизменном давлении (на изотерме это состояние соответствует горизонтальному участку). После того, как весь пар перейдет в жидкое состояние, давление начнет резко увеличиваться при дальнейшем уменьшении объема, поскольку жидкость сжимается слабо.
Необязательно проходить двухфазную область, чтобы совершить переход от газа к жидкости. Процесс можно провести и в обход критической точки. На изображении такой вариант показан при помощи ломаной линии A B C .
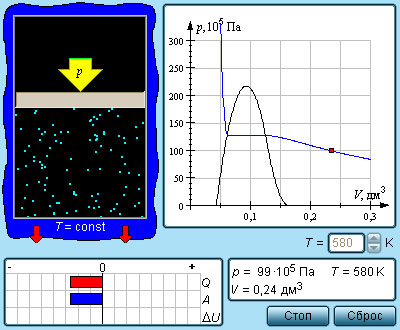
Рисунок 3 . 4 . 3 . Модель изотермы реального газа.
Воздух, которым мы дышим, при некотором давлении всегда включает в себя водяные пары. Это давление, как правило, меньше, чем давление насыщенного пара.
Относительная влажность воздуха – это отношение парциального давления к давлению насыщенного водяного пара.
В виде формулы это можно записать так:
Для описания ненасыщенного пара допустимо использовать и уравнение состояния идеального газа с учетом обычных для реального газа ограничений: не слишком большого давления пара ( p ≤ ( 10 6 – 10 7 ) П а ) и температуры выше значения, определенного для каждого конкретного вещества.
Для описания насыщенного пара применимы законы идеального газа. Однако при этом давление для каждой температуры должно быть определено по кривой равновесия для данного вещества.
Чем выше температура, тем выше давление насыщенного пара. Эту зависимость из законов идеального газа вывести нельзя. При условии постоянной концентрации молекул давление газа будет постоянно возрастать прямо пропорционально температуре. Если пар является насыщенным, то с ростом температуры будет расти не только концентрация, но и средняя кинетическая энергия молекул. Из этого следует, что чем выше температура, тем быстрее растет давление насыщенного пара. Этот процесс происходит быстрее, чем рост давления идеального газа при условии постоянной концентрации молекул в нем.
Что такое кипение
Выше мы указывали, что испарение идет в основном с поверхности, но оно также может происходить и из основного объема жидкости. Любое жидкое вещество включает в себя мелкие газовые пузырьки. Если внешнее давление (т.е. давление газа в них) уравнять с давлением насыщенного пара, то произойдет испарение жидкости внутри пузырьков, и они начнут наполняться паром, расширяться и всплывать на поверхность. Этот процесс называется кипением. Таким образом, температура кипения зависит от внешнего давления.
Жидкость начинает кипеть при такой температуре, при которой внешнее давление и давление ее насыщенных паров будут равны.
Если атмосферное давление нормальное, то для кипения воды нужна температура 100 ° С . При ней давление насыщенных водяных паров будет равно 1 а т м . Если мы будем кипятить воду в горах, то из-за уменьшения атмосферного давления температура кипения снизится до 70 ° С .
Жидкость может кипеть только в открытом сосуде. Если его герметично закрыть, то нарушится равновесие между жидкостью и ее насыщенным паром. Узнать температуру кипения при различных значениях давления можно с помощью кривой равновесия.
Кривые равновесия состояний вещества
На изображении выше с помощью изотерма реального газа показаны процессы фазовых переходов – конденсации и испарения. Эта схема является неполной, поскольку вещество может принимать также и твердое состояние. Достижение термодинамического равновесия между фазами вещества при заданной температуре возможно лишь при определенном давлении в системе.
Кривая фазового равновесия – это зависимость между равновесным давлением и температурой.
Примером такой зависимости может быть кривая равновесия жидкости и насыщенного пара. Если мы построим кривые, отображающие равновесие между фазами одного вещества, на плоскости, то мы увидим определенные области, которые соответствуют разным агрегатным состояниям вещества – жидкому, твердому, газообразному. Кривые, построенные в системе координат, называются фазовыми диаграммами.
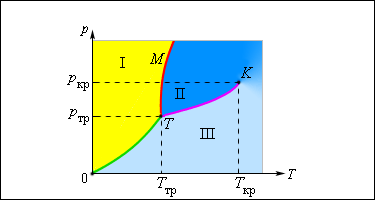
Рисунок 3 . 4 . 4 . Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область I I – жидкость, область I I I – газообразное вещество.
Равновесие между газообразной и твердой фазой вещества отображает так называемая кривая сублимации (на рисунке она обозначена как 0 T ), между паром и жидкостью – кривая испарения, которая заканчивается в критической точке. Кривая равновесия между жидкостью и твердым телом называется кривой плавления.
Тройная точка – это точка, в которой сходятся все кривые равновесия, т.е. возможны все фазы вещества.
Многие вещества достигают тройной точки при давлении меньше 1 а т м ≈ 10 5 П а . Они плавятся при нагревании в атмосферном давлении. Так, у воды тройная точка имеет координаты T т р = 273 , 16 К , p т р = 6 , 02 · 10 2 П а . Именно на ней основана абсолютная температурная шкала Кельвина.
У некоторых веществ достижение тройной точки происходит и при давлении выше 1 а т м .
Например, для углекислоты нужно давление в 5 , 11 а т м и температура T т р = 216 , 5 К . Если давление равно атмосферному, то для поддержания ее в твердом состоянии нужна низкая температура, а переход в жидкое состояние становится невозможен. Углекислота в равновесии со своим паром при атмосферном давлении называется сухим льдом. Это вещество не способно плавиться, а может только испаряться (сублимировать).