Опыты и эксперименты с водой для дошкольников
Мария Роденко
Опыты и эксперименты с водой для дошкольников
Волшебница вода
Вода, пар, лёд – одно и то же вещество![/h4]
Налить в блюдце немного воды и поставить на 2-3 часа в морозилку. Что получилось?
Поставить блюдце со льдом на стол. Через сколько времени в нём снова окажется вода? Что произойдёт со льдом – твёрдой водой?
Оставить блюдце с водой на подоконнике на 2-3 дня. Скоро ли она испарится?
Объяснение: вода, пар, лёд – одно и то же вещество, но только в разных состояниях: жидком, твёрдом и газообразном.
2. Можно ли склеить бумагу водой?
Взять два листа бумаги, приложить их друг к другу и попробовать сдвинуть их в разные стороны. Получилось?
Затем намочить листы бумаги водой, приложить их друг к другу, слегка прижать и попробовать сдвинуть их, один в одну сторону, другой в другую.
Объяснение: вода обладает «склеивающим» действием, поэтому бумагу можно склеить водой.
3. Можно ли ускорить испарение воды?
Намочить руки водой из-под крана и быстро-быстро помахать ими. Что чувствуют руки? Почему это происходит?
Объяснение: испарение воды можно ускорить, например, создавая движение воздуха. При этом частички воды испаряются быстрее, унося с собой больше тепла. Поэтому руки ощущают прохладу при взмахах руками.
Взять мелкий песок или муку, сбрызнуть водой. Образуются капельки – шарики.
Обрызгать из пульверизатора листья растения. Какие получились капельки?
Объяснение: частички собирают вокруг себя капельки воды и образуют одну большую капельку-шарик, а когда множество капелек воды попадает на лист растения, они, собираясь вместе, образуют большую каплю-шар или даже маленькую лужицу.
5. Сахар растворяется в воде.
Положить в стакан кусочек сахара и налить чай тоненькой струйкой, стараясь попадать только на сахар. Сахар постепенно будет размываться, а потом… исчезнет? Конечно, нет.
Зачерпнуть ложкой немного чая из стакана и ложку чая из чайника, попробовать и сравнить вкус. Что можно почувствовать, одинаковый ли на вкус чай?
Объяснение: сахар растворяется в воде и смешивается с ней, поэтому вода становится сладкой.
6. Соль растворяется в воде.
В стакан с водой насыпать одну столовую ложку соли и перемешать.
Что произошло? Соль «исчезла»? дать ребёнку попробовать немного воды. Какой стала вода?
Объяснение: соль не исчезла, она растворилась в воде, и вода стала солёной.
Соль выпаривается и кристаллизуется. [/h4]
В стакан с водой насыпать 2-3 ложки соли. Перемешать до полного растворения. Затем поставить на солнечное место и наблюдать за поведением соли.
Через несколько дней на стенках стакана по мере испарения воды будут появляться кристаллики соли.
Объяснение: вода испаряется, а кристаллики соли оседают на стенках стакана.
8. Песок не растворяется.
Предложить ребёнку сравнить сахар и песок, узнать, что растворяется в воде, а что нет.
Размешать в одном стакане с водой ложку речного песка, а в другом ложку сахара. Дать отстояться.
Посмотреть, что произошло с песчинками и водой.
Объяснение: вода с речным песком стала мутной, грязной. Более тяжёлые песчинки опустились на дно, а мелкие плавают в воде, делая её мутной. Сахар стал невидимым в воде, вода его растворила.
Взять два одинаковых стакана, один с водой, а другой – пустой. Опустить трубочку для коктейля в стакан с водой, зажать её сверху указательным пальцем и, не отрывая пальца, перенести её в пустой стакан. Убрать палец от трубочки, и из неё вытечет вода.
Проделав то же самое несколько раз, можно перенести всю воду из одного стакана в другой.
Плавающая рыбка. [/h4]
На картоне нарисовать и вырезать рыбку. Налить в таз воды. Окунуть зубочистку в жидкое мыло или растительное масло и поставить точку на хвостике рыбки.
Положить рыбку на воду так, чтобы хвостик оказался у края таза, в результате рыбка поплывет.
Для повтора эксперимента нужно помыть и высушить таз.
Объяснение: капелька масла растекается по воде, её частички отталкиваются от частичек воды, и в результате рыбка плывёт.
11. Плавающее яйцо.
Литровую банку наполовину наполнить водой. Ложкой осторожно опустить в неё сырое яйцо и убрать ложку. Как поведёт себя яйцо?
Аккуратно вытащить яйцо. Насыпать в ту же банку с водой полчашки (125 мл) соли и размешать ложкой. Затем опустить яйцо в воду. Как теперь ведёт себя яйцо?
Объяснение: яйцо тонет в чистой воде, потому что оно тяжелее воды. Добавляя соль в воду, мы повышаем её плотность, и поэтому яйцо плавает в ней.
12. Поющие бутылки. Высокие и низкие звуки.
Заполнить водой 3 одинаковые бутылки до половины, а затем перелить половину воды из одной в другую. Поднести бутылку к губам, подуть поверх горлышка, чтобы услышать поющий звук. Подуть над другими бутылками, одинаково ли они поют?
Расположить бутылки в порядке высоты звука.
Объяснение: выдыхаемый воздух над бутылкой заставляет вибрировать воздух внутри неё. Высота звука зависит от количества воздуха внутри бутылки.
13. Радужная бумага.
Глубокую миску наполовину наполнить водой. Аккуратно капнуть каплю прозрачного лака для ногтей, лак растечётся по поверхности воды.
Погрузить в воду кусочек чёрной двухсторонней бумаги, вынуть его и просушить. На сухой бумаге можно увидеть радужные разводы.
Объяснение: лак образует на поверхности воды тонкую плёнку. Плёнка обволакивает бумагу, и свет, попадая на неё, отражается, образуя радужный узор.
14. Распускающиеся цветы.
Нарисовать и вырезать из цветной бумаги цветы с длинными лепестками. При помощи карандаша закрутить лепестки к центру цветка.
Налить в таз воду и опустить на неё цветочки. Они начнут расправлять лепесточки и распускаться.
Объяснение: при контакте с водой бумага намокает, становится тяжелее, и лепестки цветка начинают распускаться.
15. Не выливающаяся вода.
Налить до краёв в стакан воды. Положить сверху открытку или квадрат из плотного картона. Прижимая открытку к стакану рукой, перевернуть его вверх дном над раковиной.
Убрать руку. Что произошло?
Объяснение: открытка не падает, и вода не выливается, потому что воздух, находящийся в стакане, давит на неё снизу и прижимает её к краю стакана. Вода выльется, если открытку сдвинуть.
16. Невидимые чернила.
Выдавить сок из половинки лимона в чашку, добавить такое же количество воды. Обмакнуть ватную палочку в приготовленный раствор. Написать ей что-нибудь на листе бумаги.
Когда надпись высохнет, нагреть бумагу над включённой настольной лампой. На бумаге проявятся невидимые ранее слова.
Прыгающие зёрнышки.
В стакан налить газированную воду и опустить 6 зёрнышек риса.
Подождать несколько секунд и понаблюдать сквозь стакан, как зёрнышки начнут прыгать.
Объяснение: рис чуть тяжелее воды, когда он попадает в стакан, начинает опускаться. Пузырьки газа садятся на него и поднимают вверх. На поверхности пузырьки лопаются, и газ улетучивается. Отяжелевший рис вновь опускается вниз. Он будет опускаться, и подниматься, пока вода не «выдохнется».
 Фотоотчет. Проект по ознакомлению детей младшей группы со свойствами воды Фотоотчет проекта по ознакомлению детей со свойствами воды в младшей группе. Уважаемые коллеги! Предлагаю вашему вниманию фотоотчет моей.
Фотоотчет. Проект по ознакомлению детей младшей группы со свойствами воды Фотоотчет проекта по ознакомлению детей со свойствами воды в младшей группе. Уважаемые коллеги! Предлагаю вашему вниманию фотоотчет моей.
 Кружок по экологии Вы слыхали о воде? Говорят она везде. В луже, в море, в океане И в водопроводном кране. Как сосулька замерзает, Паром в чайник заползает.
Кружок по экологии Вы слыхали о воде? Говорят она везде. В луже, в море, в океане И в водопроводном кране. Как сосулька замерзает, Паром в чайник заползает.
Можно ли готовить на морской воде. Личный опыт.
 Можно ли готовить на морской воде? Этот вопрос я задавал себе, когда собирался с семьёй пожить у моря дикарями. Ведь пресную воду надо искать, а морская всегда под рукой. Это ж какое облегчение для путешествия и туризма, если морскую воду можно пить. Какая на вкус будет еда приготовленная на этой воде, не подцепим ли расстройство желудка, не умрём ли от обезвоживания? На все эти вопросы ответ нашёлся сам собой на море.
Можно ли готовить на морской воде? Этот вопрос я задавал себе, когда собирался с семьёй пожить у моря дикарями. Ведь пресную воду надо искать, а морская всегда под рукой. Это ж какое облегчение для путешествия и туризма, если морскую воду можно пить. Какая на вкус будет еда приготовленная на этой воде, не подцепим ли расстройство желудка, не умрём ли от обезвоживания? На все эти вопросы ответ нашёлся сам собой на море.
Самые нетерпеливые читатели ответ на вопрос «Можно ли готовить на морской воде?» найдут в последнем абзаце. А для любопытствующих расскажу, в своей манере, всё по порядку.
Вероятность обезвоживания от морской воды.
В соответствии с распространённым мнением, просто пить морскую воду опасно для жизни. Многие люди, оказавшись в море после кораблекрушения, пили солёную воду и умирали от обезвоживания. Но мало кто знает, что были и те кто проведя в лодке или на плоту много месяцев в море был жив. В чём их секрет?
Солёность всех океанов и большинства морей колеблется у значения в 35 ‰ (промилле, грамм солей на килограмм (литр) воды). У закрытых морей значения более разнообразны: Красное — 41 ‰, Средиземное — 39 ‰, Чёрное — 18 ‰, Азовское — 11 ‰. А максимальное условно не токсичное содержание солей в воде для питья 15 ‰. Ясно, что просто пить морскую воду нельзя, но как же выживали люди в море.
Секрет выживания в том, что для того, чтобы прожить несколько месяцев в море, кроме воды нужна ещё еда. И люди, дрейфуя в океане, ели сырую рыбу. А рыба на 70-80 % состоит из пресной воды. Итого получаем , что если съедать больше килограмма сырой рыбы и запивать литром морской воды, то мы имеем высокие шансы на выживание.
Для справки. Рассол содержит до 60 ‰ солей и люди его безопасно употребляют, т.к. это не единственный их источник воды.
Теория привела нас к тому, что мы с семьёй имели на практике. Мы с палатками стояли на Чёрном море и для приготовления каш и супов разбавляли морскую воду пресной в пропорции 1:1 и прекрасно себя чувствовали. Естественно, никакой соли больше не добавляли в еду. Кстати Виктор, который нам подсказал такую идею экономии пресной воды, живёт в Мурманске и готовит так же на воде из Баренцева моря.
Вероятность получить расстройство желудка от морской воды.
Правда достаточно проста. На море всегда было много санаториев, так как море обладает ярко выраженным лечебным свойством. Причина в том, что солёная вода и солёный воздух токсичны не только для человека, но и для большинства тех, кто живёт в пресном человеческом теле. Конечно это не антисептик, но растворенные в ней соли ряда металлов (медь, серебро), бром, йод, сероводород убивают множество патогенных для человека микробов. Это верно и в обратном направлении: большинство того, что живёт в морской воде, не может выжить в пресном теле.
В дополнение к этому вопросу можно вспомнить рыбаков, туристов и путешественников, которые готовят еду на пресной речной или озёрной воде. Здесь подхватить какую-нибудь хворь намного легче, и в воде и в человеке пресная среда. Но нет, никто не боится.
Итог простой. Расстройство желудка не получим, если будем соблюдать ряд общепринятых правил.
1. Воду не берём рядом с городами и другими загрязняющими объектами.
2. Кипятим воду хотя бы 5 минут.
Какая еда на вкус если готовить её на морской воде.
Почему-то многие считают, что еда приготовленная на морской воде будет горькой из-за йода. Но все спокойно пользуются йодированной солью, в которой содержание йода (40±15) мг/кг против 0,7 мг/кг в морской соли.
Из-за каких минералов испортится вкус перечислять можно бесконечно. Давайте обратимся к соли, которая продаётся в магазине — морская соль. Из чего делают морскую соль? Глупый вопрос. Конечно берут морскую воду, фильтруют от песка и мелких обитателей, а затем выпаривают. Никаких дополнительных фильтраций микроэлементов не делается. И когда мы бросаем эту соль в суп, мы, грубо говоря, получаем суп из морской воды. От такой соли все только в восторге, т.к. она добавляет интересные оттенки ко вкусу блюда, но не горечь.
Мы из собственной практики убедились, что морская вода, только улучшает вкус и прекрасно усваивается. Так же она содержит множество различных минералов, которые необходимы организму.
Как готовить на морской воде.
Виктор, с семьёй которого мы познакомились на скале Киселёва в 5 км. от Туапсе, готовит на морской воде уже 15 лет. Этот человек пышит бодростью и в свои 54 года продолжает активную туристическую жизнь со своей семьёй.
Мы, глядя на него, отодвинули свои страхи и остались очень довольны. Месяц мы готовили на морской воде, разбавляя её 1:1 пресной. Набирали воду поодаль от берега, где вода не так сильно мутится волнами. Отплывали метров на 10 и набирали в 5-ти литровую бутыль. Но иногда набирали рядом с берегом, зайдя по колено в воду.
Кстати если вы поймаете краба, то его по всем морским рецептам надо варить именно в морской воде. Почитайте у нас, как поймать и приготовить краба.
Вкус у еды великолепный. Соли в самый раз при таких пропорциях, никто даже недосаливал.
За месяц пребывания расстройство желудка было только один день и то, судя по всему, от залежавшейся рыбы.
Бодрость тела и духа нас не оставили от этого эксперимента, а скорее даже прибавились, и мы за тот месяц облазили всю местность от г. Туапсе до п. Агой.
Дорогие читатели, а вы хотите попробовать блюда приготовленные на морской воде.
Кипение воды
Опыт 1. А.В. Перышкин. Физика 8, § 18.
Техника безопасности
Правила безопасности при работе со спиртовкой и стеклянной посудой.
Цель эксперимента
Наблюдать процесс кипения воды и описать основные явления, которые сопровождают процесс кипения воды.
Гипотеза:
Процесс кипения сопровождается рядом удивительных явлений
Оборудование:
Фото
- Штатив;
- Колба с водой;
- Спиртовка;
- Спички

Описание опыта
Результаты опыта
Объяснение
В лапке штатива закрепляем колбу с водой, снизу поместим спиртовку. Зажигаем спиртовку и наблюдаем за процессами, происходящими в колбе.
1. Идет обильное испарение с поверхности жидкости, над горлышком колбы образуется туман.
1. Пар невидимый, но при попадании в холодную среду (наружный воздух) происходит конденсация пара и образуется туман.
2. На внутренней поверхности стенок образуются и начинают расти пузырьки.
2. Пузырьки содержат воздух, растворенный в воде и водяной пар, который образуется за счет испарения воды внутрь пузырьков.
3. Пузырьки увеличиваются в размерах, отрываются от стенок колбы, поднимаются вверх и исчезают.
3.В холодных непрогретых слоях воды происходит конденсация пара.
4. Возникает шум предшествующий закипанию воды.
4. Шум вызван попеременным уменьшением и увеличением пузырьков в размерах, вода постепенно полностью прогревается.
5. Пузырьки всплывают на поверхность, лопаются, слышно как булькает вода, кипит.
5.Пузырьки всплывают на поверхность под действием архимедовой силы, насыщенный пар из пузырьков выбрасывается в атмосферу.
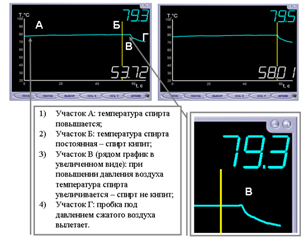
Опыт 2. Кипение воды при пониженном давлении
Жидкость закипит, если давление насыщенного пара в пузырьках будет больше суммы гидростатического давления жидкости и атмосферного давлении:
Из этого выражения вытекает, что изменив внешнее давление над водой можно изменить температуру кипения воды: при уменьшении внешнего давления температура кипения понижается, а при увеличении давления — повышается. Докажем этот вывод на опыте.
| Техника безопасности | ||
Описание опыта Результаты опыта Объяснение А) Измеряем начальную температуру в колбе. Начальная температура воды 30 °С. Когда из колбы выкачиваем воздух, то давление над жидкостью уменьшается, процесс роста пузырьков начинается при меньшем давлении, что сказывается на понижение температуры кипения. б) В лапке штатива закрепляем колбу с водой, закрываем резиновой пробкой со стеклянной трубкой. Соединим с помощью резинового шланга колбу с насосом. Из колбы выкачиваем воздух. В воде образуются пузырьки, они поднимаются на поверхность воды, лопаются, вода закипает в) Измеряем температуру воды после кипения. Конечная температура воды 29 °С (понижение температуры вызвано теплоотдачей воды окружающей среде). Опыт 3. Задача № 862 (снег заменен холодной водой)(А.Е. Марон, Е.А. Марон, С. В. Позойский. Сборник вопросов и задач Физика 7-9 к учебнику А.В. Перышкина) Оборудование: Фото | ||
|
|
|
|
||
Ссылка на видео https://cloud.mail.ru/public/4k82/e7MeqkpeB (Облако Mail.Ru)
Видео содержит все фрагменты:
- Кипение воды;
- Кипение при пониженном давлении (с помощью насоса и холодной воды);
- Кипение дистиллированной воды.
Можно ли пить морскую воду? Эксперимент по опреснению воды
 |
| Можно ли пить морскую воду? |
| Соленость воды Азовского моря всего 11 грамм соли на литр воды |
- Полиэтиленовый пакет.
- Большая широкая емкость (лучше тазик, но у нас была только кастрюля)
- Маленькая емкость для сбора воды (например, кружка)
| Глоток пресной воды |
| Катя пьет опресненную воду |
Дайвинг форум. Можно ли пить морскую воду? (http://dive-magazine.ru/t7010-mozhno-li-pit-morskuyu-vodu.html)
38 комментариев:
Очень интересно! Спасибо, прочитала с удовольствием! )))

Рада, что понравилось:)

Путешествуя по берегу Чёрного моря, я 3 раза в день, готовил еду на морской воде. Ничего не приятного, я не испытывал. Так продолжалось 3 недели.

Ну, солят же люди пищу не обычной солью, а морской. Сама по-себе она не ядовита, отравляет большая концентрация соли в организме. У вас, видимо, с концентрацией все было в порядке 
Да уж, поразительно, сколько в мире вот таких спорных вопросов. Я вот тоже думала, что по чуть – чуть можно её пить, а оказывается процент смертности от употребления морской воды выше, чем при жажде. Спасибо, Татьяна, за пост!

Да, вопрос остается спорным. Ведь кто-то же все-таки выжил, благодаря тому, что пил морскую воду. Но со статистикой не поспоришь.

весьма. спасибо за урок, Таня.
вы очень активно отдыхаете, однако ))

Рада, что понравилось:) А отдыхать мы всегда стараемся активно – я просто не могу спокойно лежать на пляже, у меня “вертячка”, как говорит муж)))

Ух ты! Очень жаль, что я наткнулась на этот пост уже поздно – мы вернулись с морского отдыха. думаю, дети были бы в восторге!

Ничего, во-первых, потом еще пригодится;) А, во-вторых, таким способом можно очищать воду от любых посторонних примесей, например, грязную воду из лужи.

Теперь мы готовы для выживания на необитаемом острове без пресной воды.))) Спасибо, очень поучительно.

Да, теперь кораблекрушение нам не страшно)))

Мы как раз отдыхаем на море и обязательно попробуем провести этот эксперимент! Спасибо!
Инна

Как здорово, что как раз вам ко времени:)

Классно! Об этот я не знала) . Расскажу своим детям. Вместе морской воды возьмем минералку или сами посолим)

))) С минералкой забавно:)

Активный и интересный у вас отдых! Вы наверное живете под девизом: “Ни дня без опытов!” ))))


я даже не знала про такое! красота. Таня, как я рада, что вы в отуск перед нами поехали. сейчас идей у тебя насобираю!!

Буду рада, если Даше наши игры тоже понравятся:)

Не догадывалась, что можно так в полевых условиях её опреснять. А добывать соль вы пробовали? Наверное, если продолжить эксперимент, получилась бы горсть соли?

Добывать соль из морской воды не пробовали – это было бы очень долго. А вот для клуба почемучек (на вопрос, почему вода в море соленая?) выпаривали соленую воду на печке и получали соль обратно.

Очень увлекательный рассказ и эксперимент, всегда читаю Вас с большим интересом))
Все мы в душе немного Почемучки))
В этом опыте есть некие секреты. Главное. Эту всю конструкцию лучше всего ставить в ВЕТРЕННОЕ место!.
И еще, это лучше всего работает в жаркий день, в холодный будет результат близкий к нулю.
Короче должно быть жарко и дуть ветер. Тогда выхлоп будет выше.
А да кстати есть еще один способ. Суть та же но подход чуть иной.
Если вы находитесь в месте где есть много довольно крупных камней то их нужно натаскать горой друг на друга чем гора больше тем лучше. Под ней надо сделать яvre куда постелить такой пакет. За счет обдувания ветром и нагревания камней на солнце из за перепада температур внутри кучи будет конденсироваться вода и скапливаться в углублении с пакетом.

Спасибо за дополнение, надо будет попробовать способ с камнями
Что будет, если вскипятить морскую воду: обзор эксперимента







 |

|
 |
| ||||||||||||||||||||||||||||||||||||||||||||||||















 Гигантский, практически неисчерпаемый источник воды — Мировой океан. Если количество воды, заключенное в океане, распределить по всей земной поверхности, она покроет ее слоем в 3800 метров. Мировой океан содержит около 1,4 миллиарда кубометров воды. Однако использовать эту воду в ее естественном состоянии для покрытия дефицита питьевого и технического водоснабжения нельзя. Вода эта соленая. Средняя концентрация солей в морской воде составляет 35 граммов на один литр. Много соленой воды находится и в недрах земли.
Гигантский, практически неисчерпаемый источник воды — Мировой океан. Если количество воды, заключенное в океане, распределить по всей земной поверхности, она покроет ее слоем в 3800 метров. Мировой океан содержит около 1,4 миллиарда кубометров воды. Однако использовать эту воду в ее естественном состоянии для покрытия дефицита питьевого и технического водоснабжения нельзя. Вода эта соленая. Средняя концентрация солей в морской воде составляет 35 граммов на один литр. Много соленой воды находится и в недрах земли.